Las propiedades del agua: isótopos y estructura molecular.
Las propiedades del agua 1: general
Las propiedades del agua 2: propiedades físicas y químicas
Composición isotópica del agua
El agua es una mezcla de varias combinaciones de isótopos de oxígeno e hidrógeno que se diferencian entre sí en la cantidad de neutrones asociados con los protones en el núcleo.
1H,2 H (Deuterio)3H (tritio)
16O, 17O,18O.
Las relaciones isotópicas son las siguientes:
Para hidrógeno:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
El tritio es un elemento inestable, su vida media es 12,5 años.
Para oxígeno:
18O/16O = 1 / 500
17O/16O = 1 / 2500
Las principales especies moleculares de 4 y sus frecuencias son las siguientes:
1H216O = 99,7%
1H2 18 O = 0,2%
1H217O = 0,04%
1HD16O = 0,03%
D216O = muy débil
Los diferentes isótopos inducen diferencias en las propiedades físicas de las moléculas, en particular en su densidad, pero las propiedades químicas siguen siendo las mismas.
Agua pesada D2O existe en su estado natural pero en muy
bajo. Para tener una cantidad apreciable de él, es necesario dominar las técnicas de separación de isótopos: este fue uno de los desafíos fundamentales durante la última guerra mundial para preparar el arma atómica.
La composición isotópica de los componentes químicos del agua se utiliza en la estimación de parámetros termodinámicos como la temperatura;
el informe 18 O/16O el hielo de los casquetes polares y el agua de las aguas subterráneas fósiles proporcionan información sobre el clima del pasado.
La evaporación del agua del océano tiene lugar con fraccionamiento isotópico: el isótopo ligero de oxígeno se evapora con preferencia al isótopo pesado. Los océanos son más ricos en isótopos pesados que el agua de las nubes y las precipitaciones.
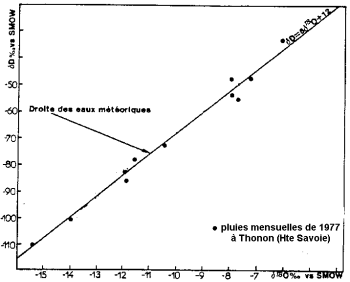
Contenido de isótopos estables de la precipitación (según Blavoux y Letolle, 1995).
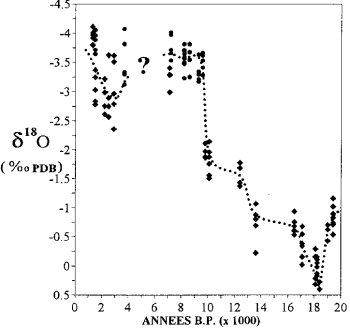
Variación del contenido de isótopos de oxígeno en los corales de Mayotte (según Casanova et al., 1994).
Estructura de la molecula
Los átomos de hidrógeno y oxígeno juntan sus electrones para formar una capa completa como la del neón. De hecho, el átomo de oxígeno carece de 2 electrones para completar su capa electrónica, son los 2 átomos de hidrógeno los que lo proporcionan. La molécula de H2O formada es estable.
Oxígeno: protones 8 + neutrones 8
Hidrógeno: 2 (2 * (protón 1 + neutrón 1))
Total: protones 10 que equilibran las cargas de los electrones 10.
Los núcleos de hidrógeno tienen un lado del del oxígeno para formar una característica "cabeza de Mickey" (el hidrógeno son las orejas).
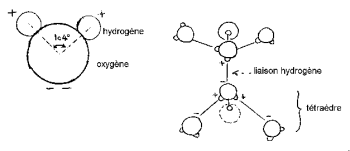
El ángulo HOH es 104,474 ° (característico de la geometría tetraédrica). La distancia entre el oxígeno y el átomo de hidrógeno es cercana a 1 A ° (0,95718 A °) en vapor. El diámetro efectivo de la molécula es del orden de 2,82 A °.
Las cargas eléctricas se distribuyen de manera desigual en esta pequeña molécula. Los electrones se sienten más atraídos por el átomo de oxígeno que por el de hidrógeno. Hay 2 centros de cargas positivas cerca de los núcleos de hidrógeno y 2 centros de cargas negativas cerca del núcleo de oxígeno. Este desequilibrio en la distribución de cargas, combinado con la geometría no lineal de la molécula de agua, se manifiesta en la existencia de un fuerte momento dipolar eléctrico. La molécula de agua es polar; se comporta como un dipolo eléctrico que puede unirse con otras moléculas polares. De hecho, las moléculas de agua pueden insertarse entre los iones constituyentes de un cristal dirigiendo su parte de carga eléctrica opuesta hacia ellos. La atracción de iones cristalinos se debilita mucho y se reduce la cohesión del cristal, lo que facilita su disolución. Las propiedades polares de la molécula de agua explican la técnica del calentamiento por microondas. De hecho, una molécula polarizada se orienta con respecto a un campo eléctrico; si esto varía, la molécula sigue el cambio de orientación. A partir de una determinada frecuencia, unos pocos GHz para el agua, los movimientos de las moléculas producen calor por fricción. Los hornos domésticos suelen funcionar a una frecuencia de 2,45 GHz, que es UHF.
Los 3 núcleos de la molécula no están estacionarios, se mueven entre sí, la molécula vibra y se retuerce. En el agua líquida, las moléculas tienden a asociarse: las cabezas de Mickey unen la oreja al mentón mediante enlaces de hidrógeno. De hecho, de los 8 electrones periféricos del oxígeno, solo 4 están involucrados en enlaces covalentes con átomos de hidrógeno. Los 4 electrones restantes se agrupan en 2 pares llamados dobletes de electrones libres. Cada uno de estos dobletes cargados eléctricamente negativamente puede formar un enlace electrostático con un átomo de hidrógeno cargado positivamente de una molécula de agua cercana. Sin embargo, el enlace de hidrógeno, que es estable a temperatura ambiente, es frágil en comparación con el enlace covalente. En la molécula de agua, la geometría formada por la dirección de los 2 enlaces covalentes y los 2 dobletes electrónicos libres es cercana a la de un tetraedro cuyo centro está ocupado por los núcleos de oxígeno.
Sin embargo, la gran estructura de la molécula de agua todavía se conoce de manera imperfecta. Los espectros de difracción de rayos X y neutrones proporcionan 2 valores principales: una señal correspondiente a 1 A °, distancia entre los núcleos de hidrógeno y oxígeno, y un valor de 2,84 a 4 A ° que varía según la temperatura y correspondiente a la distancia entre 2 núcleos de oxígeno. La difractometría de rayos X también permite conocer el número medio de moléculas por unidad de volumen de líquido situadas a una distancia R de una molécula determinada. Una molécula de agua tiene un promedio de 4,4 vecinos, lo que sugiere una malla tetraédrica. Además de las moléculas unidas por enlaces de hidrógeno, existen otras moléculas no unidas, lo que puede explicar por qué el número de moléculas vecinas es ligeramente mayor que 4, y no 4 exactamente como impondría un estado cristalizado tetraédrico estricto. La red cristalina de moléculas unidas por enlaces de hidrógeno formaría cavidades donde se alojarían las moléculas sueltas. Otra hipótesis se basa en la distorsión de los enlaces de hidrógeno. Este último, originalmente lineal, es decir con los átomos O - HO alineados, podría girar en diversos grados y permitir que moléculas más distantes que las vecinas cercanas se acerquen a la molécula central.
Recientemente, se han desarrollado modelos teóricos utilizando potentes ordenadores. Indican que alrededor del 80% de las moléculas de agua están involucradas en 3 o 4 enlaces de hidrógeno; por otro lado, excluyen la presencia de moléculas libres. Los modelos informáticos sugieren que a medida que el agua se enfría, las redes de moléculas se parecen cada vez más a hexágonos similares a los del hielo.
El estado sólido corresponde a una disposición cristalina más estricta. A presión normal, el hielo tiene una estructura hexagonal. A baja temperatura (por debajo de -80 ° C), puede tomar una estructura cúbica. Las cargas eléctricas pueden moverse en la red cristalina y producir defectos cristalinos de tipo iónico: protón hidratado H3O + e ion hidroxilo OH-. La red cristalina del hielo no corresponde al apilamiento de moléculas más compacto posible. Tras la fusión, los defectos colapsan porque los enlaces de hidrógeno se rompen y las moléculas se acercan: la densidad aumenta hasta un máximo a 4 ° C. Posteriormente, en agua líquida, el aumento de temperatura separa las moléculas y la densidad disminuye.
Para saber más, referencias y bibliografía:
Blavoux B. y Letolle R. (1995) - Contribución de las técnicas isotópicas al conocimiento de las aguas subterráneas. Geochronics, 54, pág. 12-15.
Caro P. (1990) - Las propiedades físicas y químicas del agua. El gran libro del agua, La Villette, p. 183-194.
Eagland D. (1990) - La estructura del agua. The Research, 221, pág. 548-552.
Maidment DR (1992) - Manual de hidrogeología. Mc Graw Hill.
Casanova J., Colonna M. y Djerroud K. (1994) - Geoprospectiva - paleoclimatología. Rapp. científico BRGM, pág. 76-79.

